细胞治疗基因递送载体——慢病毒载体的生产工艺
|
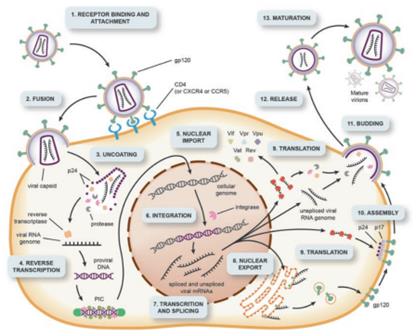 图1 慢病毒感染宿主细胞机制示意图
赛默飞生物工艺 LVV 生产解决方案可帮助提高载体上游包装滴度,优化下游纯化工艺路线,缩短用于质量检测的分析方法开发时间,帮助降低 LVV 生产成本。
LVV 生产工艺可分为上游病毒包装和下游病毒纯化两个主要阶段(图 2)。病毒载体的上游是指产生病毒载体的步骤,这是通过将 DNA 转移到用作载体工厂的包装细胞中实现的。
图2 LVV 生产工艺示意图。
在工艺开发阶段,病毒载体的包装通常在 2D 细胞培养中完成,并放大到用于临床和商业生产的生物反应器中进行生产。使用的细胞是永生化细胞系,最常见的是人胚肾细胞系 HEK293T。
由于目前大规模生物反应器仅适用于悬浮细胞培养,但是 HEK293T 是一种贴壁细胞系,因此面临着大规模生产的挑战。目前一些适应贴壁细胞培养的反应器培养方案,例如填充床生物反应器,有望成为解决贴壁细胞放大难的有效方案。此外,还可通过将贴壁的 HEK293T 细胞驯化为悬浮细胞,解决 LVV 难以规模化生产的问题。
病毒载体的包装从生产细胞系(例如 HEK293T 细胞)的扩增开始,然后用质粒 DNA (pDNA) 转染细胞以转移慢病毒颗粒生产所需的基因。病毒载体颗粒成熟后,从生产细胞膜出芽并释放到细胞培养基中,收获细胞培养上清液即可得到 LVV。因此,区别于其他无包膜载体(例如腺相关病毒 (AAV) 载体),慢病毒载体不需要细胞裂解步骤来释放病毒颗粒。
针对 LVV 的上游细胞培养阶段,不论是贴壁工艺还是悬浮工艺,赛默飞均有相应的解决方案供选择(图 3)。
 图3 赛默飞生物工艺 LVV 上游细胞培养工艺
LVV 的下游纯化始于细胞培养上清液的收获。LVV 收获液高度异质化,含有大量工艺和产品相关杂质。常见工艺路线如图 4 所示。
 图4 LVV 下游纯化工艺路线示意图
由于慢病毒颗粒极易失活,因此,在进行 LVV 纯化时,应考虑简化下游纯化工艺路线,以减少纯化过程中的病毒载体损失,提高回收率。CaptureSelect 慢病毒 VSVG 亲和填料经过专门设计,专用于纯化 VSV-G 假型慢病毒颗粒,结合容量为 1x1011 总颗粒数/mL填料。洗脱条件温和,有助于保持包膜病毒颗粒的感染活性。如图 5 所示,LVV 收获液经全能核酸酶处理和澄清过滤后,利用 CaptureSelect 慢病毒 VSVG 亲和填料纯化,经测试,LVV 的活性滴度回收率可达 50% 以上。
 图5 CaptureSelect 慢病毒 VSVG 亲和填料纯化工艺路线图(左)和图谱(右)
GMP 级别 LVV 的关键质量属性(CQA)涉及多个检测项目,包含外观、理化、杂质、无菌等多个方面。表 1 是目前行业内对 LVV 关键质量属性进行检测的常用方法和标准。其中,qPCR 技术是应用得较为广泛的检测技术,可用于多个指标的检测。赛默飞可提供多个基于 qPCR 技术的检测试剂盒,可用于慢病毒物理滴度、感染滴度、HEK293 细胞残留DNA、质粒 DNA 残留、支原体的检测。
 表 1 LVV 的关键质量属性(CQA) |


 微信公众号下单更便捷
微信公众号下单更便捷