|
自身免疫性疾病(autoimmune disease, AID)是由于免疫系统对自身抗原失去免疫耐受,进一步诱发组织损伤和炎症反应并最终导致靶器官受损的一类慢性疾病。目前已知的AID有100多种,累及多器官、多系统。AID总体发病率占世界人口的5%,被世界卫生组织列为继心脑血管疾病、癌症后威胁人类健康的第三大杀手。中国保守估计有5000万人患有AID,自身抗体检测对AID的预测、诊断和治疗至关重要。
自免疾病诊断市场规模
近几年,伴随AID发病率日益升高的同时,AID疾病的早诊率也在逐年提升,这主要得益于自身抗体检测技术的发展和普及。近二十年来,作为自身抗体检测的经典方法学,间接免疫荧光法(IIFT)、免疫印迹法(IBT)和酶联免疫吸附法(ELISA)已经成为自身免疫性疾病实验室诊断的主流方法,适用于不同层级的医院,其检测效能在长期的临床实践获得了验证和认可,被国内外相关指南和专家共识所推荐。
与此同时,我国自身抗体检测的市场规模也在不断提高,据新冠疫情前数据推测,预计2023年我国自身抗体检测市场规模在22.3亿元左右,2018~2023年复合增长率在14%左右。
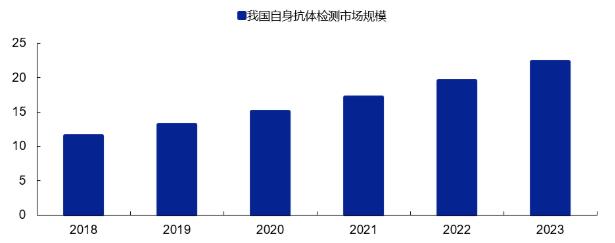 资料来源:安信证券研究中心、立鼎产业研究调研 资料来源:安信证券研究中心、立鼎产业研究调研
自身抗体检测方法浅析
对于自身抗体的检测,特别是常规检测项目—抗核抗体(ANA)的检测,IIFT一直都是检测方法的“金标准”。而对于特异性自身抗体检测,目前市场上不断有新的方法学出现,从经典的免疫印迹法、ELISA、到化学发光法(CLIA)、流式荧光法和磁条码免疫荧光法。针对如此多样的方法学,本文将进行系统的介绍,为临床实验室进行正确选择提供参考。
间接免疫荧光
间接免疫荧光技术(IIFT)因其独具的技术优势成为自身抗体检测的“金标准”,是国内外公认的自身抗体筛查首选方法。
首先,该方法以细胞或组织为检测基质,保留了抗原谱的完整性,保证了自身抗体筛查的敏感性。如HEp-2细胞包含了多达100种靶抗原,可以做到对抗核抗体的全面筛查。同时,以抗原转染细胞为基质的IIFT亦是一种特异性抗体确认方法。 该技术将细胞中含量较低的靶抗原以其天然构象大量表达在细胞表面,极大提高了特异性抗体检测的灵敏度和特异性。
随着IIFT技术的广泛应用,临床实验室对自动化要求日益迫切,目前市场上已经推出了从加样到判读的全自动化检测平台,大大提升了实验室的工作效率并提高了检测结果判读的标准化。
免疫印迹法
免疫印迹法作为多指标联检的特异性抗体确认技术,自90年代初进入中国以来,现已普遍应用于自身抗体检测。该技术是将各种特异性抗原呈条带状包被于理化性质相匹配的不同材质的膜基质上,各种抗原包被带之间间隔一定的距离,由此保证了检测结果的高灵敏高特异性,并完全避免各种抗原间的结果干扰。
根据2022年国家卫生健康委临床检验中心(NCCL)室间质评上报的1752家实验室数据统计,ENA靶抗原检测的方法学中,使用免疫印迹法的实验室占比80%,是目前自免领域份额占比最大的方法学,且质评结果准确率达到98%,可以看出免疫印迹法使用率很高,备受临床实验室的认可,是自身抗体检测的主流方法学。
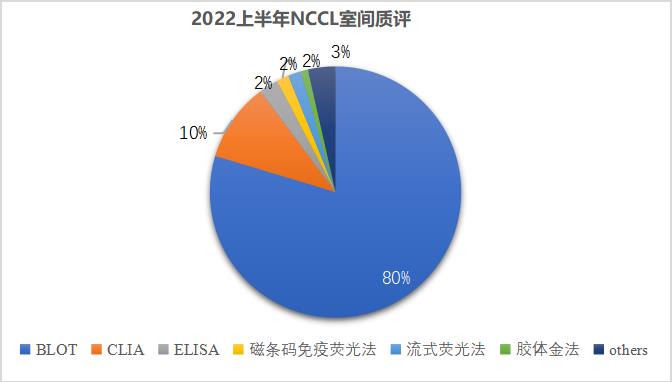
免疫印迹法备受青睐,究其原因主要是该技术操作简单、性能优异,多指标联检完全符合临床特异性抗体筛查和确认的需求,经济又高效。此外,免疫印迹法提供的是具有临床意义的半定量检测结果,这种半定量等级结果和抗体水平呈线性相关,且这种相关性已经过长期的临床验证,为临床诊断的把握度和病情的严重程度判断提供了依据。
因此,免疫印迹法凭借自身的诸多优势,稳居自身抗体靶抗原确认检测方法中的主导地位。
化学发光法
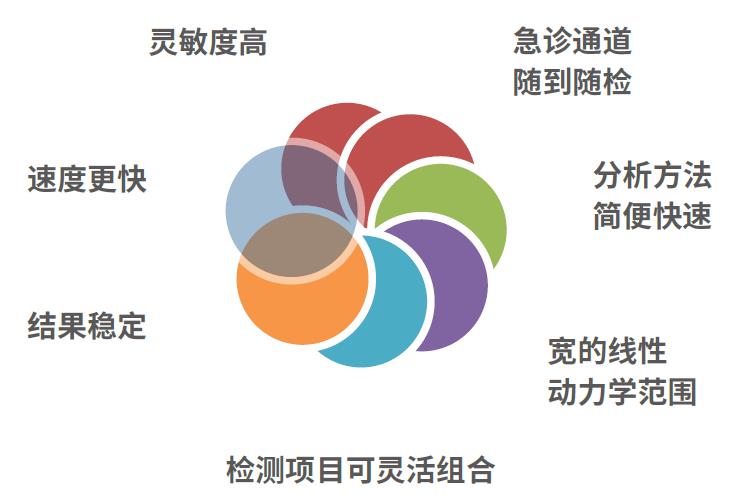
化学发光法(CLIA)是一种将高特异性的免疫反应和高灵敏度的化学发光测定技术相结合的检测技术。该技术根据化学反应产生的辐射光强度来确定物质含量,用于各种抗原、半抗原、抗体、激素、酶、脂肪酸、维生素和药物等的检测。CLIA具有反应速度快、检测灵敏度高、线性范围宽、精密度高,可随到随检等优势。
其中,吖啶酯直接化学发光是目前比较公认的高性能检测技术,具有标记物稳定、信号强、背景低、干扰因素少、灵敏度高等诸多优势。如吖啶酯对被标记的抗原、抗体活性无影响,完整保留了抗原抗体的表位活性;吖啶酯光释放快速集中,且发光效率和发光强度均较大;更重要的是,该反应体系无需催化剂和增强剂,只要在H2O2和OH-存在下就能迅速产生化学发光,可以极大的降低背景发光值,提高信噪比。
CLIA近几年被广泛应用于自身抗体检测领域,根据国家风湿病数据中心(CRDC)室间质评数据统计,从2015年到2020年的5年间,使用CLIA检测的实验室不但从无到有,且数量占比大幅上升,如dsDNA和MPO/PR3抗体检测,2020年采用CLIA的实验室占比分别达到14.7%和 22.4%。可见CLIA在自身抗体检测领域占有率越来越高。
相关研究和指南均指出ANA、ANCA中多种特异性抗体的水平与疾病严重程度、活动度、预后等相关,对随访监测有指导意义。如,dsDNA抗体、核小体的抗体水平与疾病活动度相关[1],MPO抗体滴度与肾小球新月体形成数目及疾病活动度相关等[2]。2020年《自身免疫病抗体检测方法的推荐意见》也推荐CLIA用于多种自身抗体的检测[3]。因此CLIA对自身抗体的定量检测结果能为临床提供更多的参考,符合自身抗体检测的临床需求和发展趋势。同时,因CLIA为单指标检测,可根据疾病临床诊断路径对相应的指标进行单独或组合检测,不必每次进行全套自身抗体谱检测,因此,可以降低医保及患者负担,符合DRG/DIP政策的实施。
对于化学发光在自身抗体检测方面的应用,已经有很多研究。如对于系统性红斑狼疮患者的ANA检测[4],CLIA的检测灵敏度、特异性、阴阳性预测值都高于流式荧光(见表一),且CLIA与金标准IIFT的阳性和阴性符合率均高于流式荧光法,CLIA与免疫印迹法的阳性和阴性符合率也均高于流式荧光法(见表二)。
表一:ANA检测方法对SLE的诊断价值

表二:不同方法学检测ANA的一致性分析
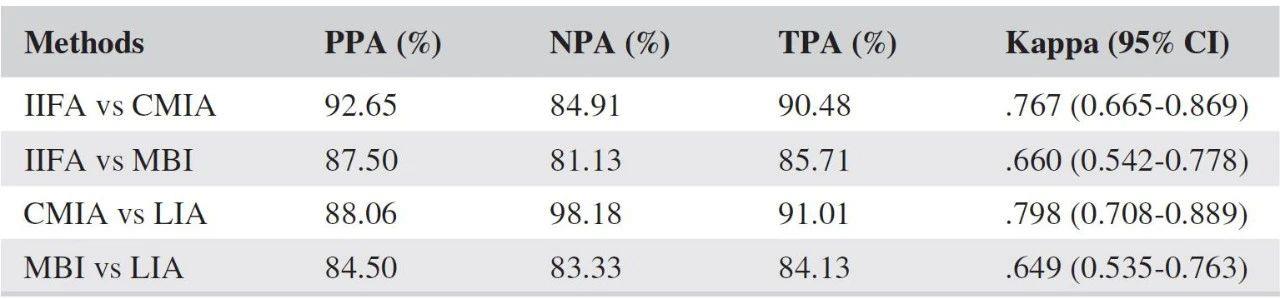
注:IIFA(间接免疫荧光法)、CMIA(化学发光法)、MBI(流式荧光法)、LIA(免疫印迹法)
因此,CLIA作为单指标定量检测,具有快速、高灵敏、线性范围宽等诸多技术优势,能真正满足临床对检测结果的定量需求,会成为未来检测自身抗体的趋势。
流式荧光法
流式荧光法是基于荧光编码微球和流式技术,主要应用于蛋白和核酸检测领域,近几年被用于自身抗体检测领域,和免疫印迹法一样同属于多指标联检技术。该技术是以不同荧光编码微球标记各类靶抗原的液相反应体系,免疫反应后,通过流式检测仪测定各类靶抗原对应的二抗荧光强度,以此来检测样本中的自身抗体。对于抗核抗体多指标筛查,除dsDNA和C1q为定量外,其他14项指标均不能进行定量检测。因此,虽然流式荧光检测可提供数值化结果,但这些指标的数值结果并不能准确代表样本中抗体水平的高低。
流式荧光技术具有全自动化、多指标联检、随机进样等优势,但该技术在自身抗体检测领域的应用时间较短,产品性能未被临床长期验证,并且检测技术还有待改进之处。如,该技术受嗜异性抗体干扰比较突出,Kricka等报道[5]超过80%的人血清中含有异嗜性抗体,至少一半人的血清可以产生这种非特异性结合。Waterboer T团队发现[6],在流式荧光检测中,至少59%的非洲人血清中的嗜异性抗体可以和微球产生非特异性结合,导致检测的背景信号过高干扰检测结果。虽然可以通过优化微球处理技术来抑制这种非特异性结合,但同时也会抑制特异性结合。其次,流式荧光的检测结果易受温度影响,从而降低了检测结果的准确性。有研究对涵盖高、中、低浓度的临床样本进行分析,与定标温度25℃偏差±5℃时,测值出现显著的负偏倚,从而导致阳性样本可能出现阴性结果,高滴度样本出现低滴度结果[7];此外,流式检测中用到的鞘液对温度要求高,为保证液流断点的稳定性,室温需要控制在25°C±1°C,如果温度升高或降低都会影响检测性能;同时鞘液容易造成仪器玻璃管堵塞,导致玻璃管损耗率高,增加用户检测成本。所以,在流式荧光的日常检测中,实验室必须注意严格控制仪器和环境的温度。
因此,流式荧光法在检测自身抗体方面,还需要走一段较长的道路,弥补在稳定性、检测结果参考价值等方面的不足,特别是需要较长时间的临床验证。
磁条码免疫荧光
磁条码免疫荧光技术近两年开始用于自身抗体检测领域,也是一种液相多指标联检方法。该技术特点主要为通过各种光刻标记的芯片偶联不同抗原,免疫反应结束后,通过明场拍照识别各类靶抗原位置、暗场拍照测定各类靶抗原对应的二抗荧光强度,以此来检测样本中所含的自身抗体。同样,对于抗核抗体筛查,除抗dsDNA抗体为定量检测,其他14个指标均为定性检测。因此,也需要注意,这些定性指标的检测结果虽有数值表示,但和抗体水平并无显著相关性。
磁条码免疫荧光检测技术具有全自动化、随机进样等优势,但在自身抗体检测领域起步较晚,技术还不够成熟。首先,在反应信号检测时,同一反应孔中各芯片之间的荧光信号有可能互相干扰,从而影响检测结果的准确性。例如,在拍照读取结果时,芯片之间容易重叠,强荧光对弱荧光产生影响;拍照不能有效采集到芯片反面的荧光。其次,芯片的尺寸过大,在反应体系中不能稳定分散,导致抗原抗体的不能充分结合。
因此,在自身抗体检测方面,磁条码荧光技术属于刚起步,还需进行持续的技术完善,并经过长期的临床验证后,才能真正成为符合临床检测要求的方法学。
各方法学特点汇总
综合临床实践以及实际操作中的表现,将各方法学汇总比对如下表:

1.在定量方面, 化学发光法能进行定量检测,可满足临床精准检测需求;免疫印迹法可提供灰度数值和结果等级的半定量结果,等级结果和抗体水平显著相关;流式荧光法和磁条码免疫荧光法以定性/半定量检测为主,其数值结果和抗体水平无显著相关性。因此,对于非定量检测的指标过度强调其数值结果将误导临床对病情严重程度的判断。
2.在检测项目选择方面,免疫印迹法、流式荧光法及磁条码免疫荧光法均为多指标联检的方法,适于抗体谱筛查。化学发光法检测为单指标检测, 抗体项目可以按需灵活选择,在通量较大的检测平台上亦可进行抗体谱筛查。
3.在检测通量方面,免疫印迹法和流式荧光法及磁条码免疫荧光法的整体水平相当。因后两者的技术尚不稳定,实验室需先得到质控品检测的结果,才开始检测样本,所以在整体检测通量上三者相当。
4.在检测性能方面:免疫印迹法和化学发光法无指标间的相互干扰,并且其非特异性干扰也远低于流式荧光法和磁条码免疫荧光法,技术成熟度相对较高,检测结果较为稳定可靠。
上述各方法学的性能差异也体现在室间质评的结果上。如2021-2022 NCCL质评验证结果显示,磁条码免疫荧光法和流式荧光法检测的质评通过率较低,特别是对于RNP和Sm指标的质评结果, 这两种方法的假阴性率高达35%和72%;而使用免疫印迹试剂检测的实验室数量多达800+家,质评通过率高;化学发光试剂用户不多但质评通过率很高。

总结
综上所述,免疫印迹法经历了长期的用户验证,性能已经被广泛认可,在今后很长时间内依旧是临床主要的检测方法。
流式荧光法和磁条码免疫荧光法是近几年开始应用于自身抗体检测领域,起步较晚,在临床应用中的优势尚不明显。两者以定性检测为主,稍逊于免疫印迹法的半定量。由于其发展时间尚短,技术还在逐步发展和完善过程中,所以在检测性能、用户认可度等方面也有待提升。
在自身抗体检测领域,化学发光法是全定量检测的代表方法学。由于其是单指标检测,可灵活组合,符合DRG/DIP的医保政策和临床精准检测需求,是今后定量检测需求的不二选择。
随着时代的发展,医学技术的不断创新与进步,未来将会有越来越多的方法学应用于自身抗体检测领域,可谓百家争鸣。各种方法学有其各自的优势与短板,正可谓一枝独秀不是春,百花齐放春满园。自身抗体检测技术的蓬勃发展,为用户带来了更多的选择空间,满足了更多的应用场景。用户只需从使用的需求出发,对方法学进行全面的评估,就能找到最适合自己实验室的检测技术。
参考文献:
1.Shang XY et al. Anti-dsDNA, anti-nucleosome, anti-C1q, and anti-histone antibodies as markers of active lupus nephritis and systemic lupus erythematosus disease activity, Immun Inflamm Dis. 2021;1–12.
2.吕远帆,帅宗文.抗髓过氧化酶物自身抗体对MPO-ANCA相关性血管炎临床表现的影响[J].安徽医学.2014,35(2):259-261.
3.免疫学会临床免疫分会专家组.自身免疫病抗体检测方法的推荐意见[J].中华检验医学杂志.2020,43(9):878-888.
4.Kricka LJ. Human Anti-Animal Antibody Interferences in Immunological Assays. Clin Chem,1999, 45(7):942-56.
5.Wei QJ et al. Comparison of chemiluminescence microparticle immunoassay, indirect immunofluorescence assay, linear immunoassay and multiple microbead immunoassay detecting autoantibodies in systemic lupus erythematosus. Scand J Immunol. 2020, 91(3): e12849.
6. Waterboer T et al. Suppression of non-specific binding in serological Luminex assays. Journal of Immunological Methods, 2006, 309 (1-2): 200–204.
7.贺雯,邹雅如,鲁琼等.环境温度对Luminex流式荧光免疫分析法测定糖类抗原242结果的影响[J].第二军医大学学报,2019,(第7期)
本文来自IVD资讯,如有侵权请联系删除!
|

 资料来源:安信证券研究中心、立鼎产业研究调研
资料来源:安信证券研究中心、立鼎产业研究调研






 微信公众号下单更便捷
微信公众号下单更便捷